hydrogen isotope
수소의 주요 동위원소는 **프로튬(수소-1), 중수소(수소-2), 삼중수소(수소-3)**입니다. 모든 수소 동위원소는 양성자를 1개 가지고 있지만, 중성자 수에서 차이가 있습니다. 프로튬은 중성자가 없고, 중수소는 1개, 삼중수소는 2개의 중성자를 가지고 있습니다. 프로튬과 중수소는 안정적인 반면, 삼중수소는 방사성입니다.
1. 프로튬(수소-1, ¹H)
- 중성자: 0
- 존재량: 수소의 99.98% 이상을 차지하는 가장 풍부한 동위원소.
- 안정성: 안정적.
2. 중수소(수소-2, ²H 또는 D)
- 중성자: 1
- 존재량: 안정적이며 자연적으로 발생.
- 용도: 핵융합로, 과학 연구의 추적자, 중수(D₂O) 형태로 사용.
3. 삼중수소(수소-3, ³H 또는 T)
- 중성자: 2
- 존재량: 자연적으로 소량 발견되며 핵 실험 중에 생성되는 희귀한 동위원소.
- 안정성: 약 12.32년의 반감기를 갖는 방사성.
- 용도: 시계에 방사성 발광 페인트로 사용되며 지질 및 생물학 연구에서 추적자로 사용.
기타 동위원소
수소는 또한 더 많은 중성자를 갖는 수소-4부터 수소-7(⁴H-⁷H)과 같이 불안정한 인공 동위원소도 가지고 있습니다.

이미지에 대한 설명:
이미지는 수소의 세 가지 동위원소인 프로튬, 중수소, 삼중수소의 원자 구조를 보여줍니다.
- 프로튬(¹H): 핵에 빨간색 양성자(p)가 하나 있고, 그 주위를 파란색 전자가 돌고 있습니다.
- 중수소(²H): 핵에 빨간색 양성자(p) 하나와 검은색 중성자 하나가 있으며, 그 주위를 파란색 전자가 돌고 있습니다.
- 삼중수소(³H): 핵에 빨간색 양성자(p) 하나와 검은색 중성자 두 개가 있으며, 그 주위를 파란색 전자가 돌고 있습니다.
각 동위원소 아래에는 이름과 함께 "Hydrogen-1", "Hydrogen-2", "Hydrogen-3"라고 표시되어 있습니다.

표 캡션 요약 :
수소 동위원소(프로튬, 중수소, 삼중수소)의 원자 및 분자 특성을 비교한 표입니다. 질량, 안정성, 존재량, 열역학적 특성 등에서 차이를 보여줍니다.

이미지가 보여주는 것:
- 입자 구성: 이미지는 수소 동위원소의 핵심 구성 요소인 양성자(p⁺), 중성자(n⁰), 전자(e⁻)의 수를 명확히 보여줍니다. 이는 동위원소의 질량 차이를 이해하는 데 중요합니다.
- 핵 구조: 각 동위원소의 핵 구조는 이미지에서 시각적으로 뚜렷하게 나타납니다. 이를 통해 동위원소 간의 핵 구성 차이를 쉽게 파악할 수 있습니다.
- 기본 모델: 이미지는 원자 구조의 단순화된 모델을 제공합니다. 전자는 특정 궤도를 돌고 있는 것으로 표현되어 있지만, 실제로는 확률적으로 분포되어 있습니다.
hydrogen isotope
The main isotopes of hydrogen are **protium (hydrogen-1), deuterium (hydrogen-2), and tritium (hydrogen-3)**. All hydrogen isotopes have one proton, but there is a difference in neutron numbers. Prothium has no neutrons, deuterium has one, and tritium has two neutrons. Prothium and deuterium are stable, whereas tritium is radioactive.
1. Prothium (hydrogen-1, 1H)
- Neutron: 0
- Abundance: The most abundant isotope, accounting for more than 99.98% of hydrogen.
- Stability: Stable.
2. Deuterium (hydrogen-2, 2H or D)
- Neutrons: 1
- Abundance: Stable and naturally occurring.
- Use: Fusion reactor, tracer of scientific research, use in the form of heavy water (D2O).
3. Tritium (hydrogen-3, 3H or T)
- Neutrons: 2
- Abundance: Rare isotopes found in small natural amounts and produced during nuclear testing.
- Stability: Radioactive with a half-life of about 12.32 years.
- Use: Used as radioluminescent paint on watches and as a tracer in lipid and biology studies.
Other isotopes
Hydrogen also has unstable artificial isotopes, such as hydrogen-4 to hydrogen-7 (4H-7H), which have more neutrons.
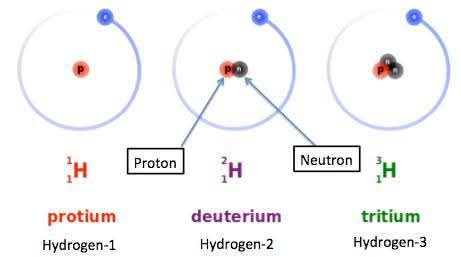
Description of the image:
The image shows the atomic structure of three isotopes of hydrogen: protium, deuterium, and tritium.
- Prothium (1H): There is a red proton (p) in the nucleus, and blue electrons are orbiting around it.
- Deuterium (2H): There is a red proton (p) and a black neutron in the nucleus, and blue electrons are orbiting around it.
- Tritium (3H): There is one red proton (p) and two black neutrons in the nucleus, and blue electrons are orbiting around it.
Below each isotope, together with the name, are labeled "Hydrogen-1", "Hydrogen-2", and "Hydrogen-3".
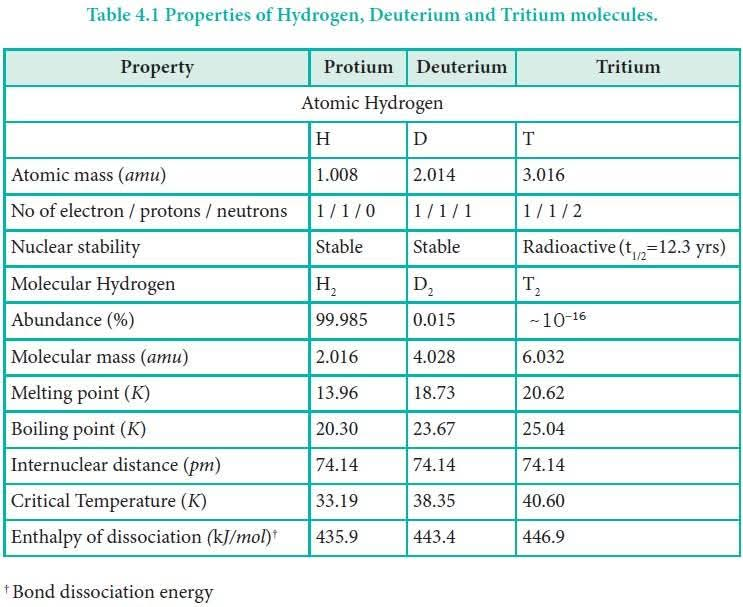
Table caption summary:
A table comparing the atomic and molecular properties of hydrogen isotopes (protium, deuterium, tritium). It shows differences in mass, stability, abundance, thermodynamic properties, etc.

What the image shows:
- Particle composition: The image clearly shows the number of protons (p+), neutrons (n0), and electrons (e−), which are key components of hydrogen isotopes. This is important for understanding the mass difference of isotopes.
- Nuclear structure: The nuclear structure of each isotope is visually distinct in the image. This makes it easy to identify differences in nuclear composition between isotopes.
- Basic model: Images provide a simplified model of atomic structure. Electrons are represented as orbiting a particular orbit, but they are actually distributed probabilistically.
More closely
Bridge of Love and Compassion